LABORATORIO QUÍMICA
NEUTRALIZACIÓN
Introducción
La presente investigación se refiere al tema de la neutralización, que se puede definir como una reacción química que ocurre entre un ácido y una base produciendo una sal y agua, también es la combinación de cationes de hidrógeno y de aniones hidróxido para formar moléculas de agua. Las características de estas reacciones químicas son, las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor, en una reacción química;los cuerpos o sustancias experimentan transformaciones que alteran su composición dando origen a: sustancias nuevas, cambiando sus propiedades. Las que experimentan cambios se denominan reactivos y los que se forman productos, de la reacción química formado por un ácido base se obtienen compuestos llamados sales. Para analizar este tema, fue necesaria la intervención de la maestra y la experimentación en la plataforma de Yenka.
objetivos
- Profundizar sobre el tema de la neutralización.
- Aplicar los entendimiento vistos sobre las sales y los ácidos.
- Comprender que a partir de este tipo de reacciones se puede calcular la Normalidad.
- Reconocer que las reacciones que se hacen entre disoluciones ácidas y básicas dan como producto sal y agua.
Marco teórico
La reacción entre un ácido y una base se llama neutralización. Cuando en la reacción participan un ácido fuerte y una base fuerte se obtiene una sal y agua. Si una de las especies es de naturaleza débil y la neutralización se produce en disolución acuosa también se obtiene su respectiva especie conjugada y agua. Se puede decir que la neutralización es la combinación de iones hidronio y de aniones hidróxido para formar moléculas de agua. Durante este proceso se forma una sal.
La palabra "sal" describe cualquier compuesto iónico cuyo catión provenga de una base (Na+ del NaOH) y cuyo anión provenga de un ácido (Cl- del HCl).Se les suele llamar de neutralización porque al reaccionar un ácido con una base, estos neutralizan sus propiedades mutuamente.
Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor.
Podemos resumir el proceso así:
ácido + base → sal + agua
Por ejemplo: HCL+ NaOH+H2O
En el momento de la neutralización se cumple que el número de equivalente se ácido que han reaccionado ( N . V ) es igual al número de equivalentes de la base ( N´ . V´ ). Según el carácter del ácido y de la base reaccionante se distinguen cuatro pasos:
ácido fuerte + base fuerte
ácido débil + base fuerte
ácido fuerte + base débil
ácido débil + base débil
La palabra nautralización se puede interpretar como aniquilación o como eliminación, lo cual no está muy lejano a la realidad. Cuando un ácido se mezcla con una base ambas especies reaccionan en diferentes grados que dependen en gran medida de las concentraciones y volúmenes del ácido y la base a modo ilustrativo se puede considerar la reacción de un ácido fuerte que se mezcla con una base débil, esta última será neutralizada completamente, mientras que permanecerá en disolución una porción del ácido fuerte, dependiendo de las moles que reaccionaron con la base. Pueden considerarse tres alternativas adicionales que surgen de la mezcla de un ácido con una base:
- Se mezcla un ácido Fuerte con una base fuerte: Cuando esto sucede, la especie que quedará en disolución será la que esté en mayor cantidad respecto de la otra.
- Se mezcla un ácido débil con una base fuerte: La disolución será básica, ya que será la base la que permanezca en la reacción.
- Se mezcla un ácido débil con una base débil: Si esto sucede, la acidez de una disolución dependerá de la constante de acidez del ácido débil y de las concentraciones tanto de la base como del ácido.
Cuando se combina una disolución acuosa de un ácido con otra de una base, tiene lugar una reacción de neutralización. Esta reacción en la que, generalmente, se forman agua y sal, es muy rápida.
El agua se forma por la unión del ión positivo H+ (o H3O+) proveniente del ácido, y el anión OH- proveniente de la base.
La sal se forma por la unión entre el metal de la base y el anión del ácido.
Ejemplo: HCL(ac) + NaOH(ac)→ NaCl(ac) + H2O
Cuando la reacción de neutralización tiene lugar entre un ácido orgánico y el Hidróxido de sodio o el Hidróxido de potasio la reacción se conoce como reacción de saponificación y la sal obtenida se conoce como jabón.
Los ácido grasos más convenientes en los jabones son el láurico, el mirístico, el palmítico y el oleico, que contienen de 12 a 18 átomos de carbono.
Los jabones de Sodio son duros, mientras que los de Potasio son blandos y de mayor solubilidad, por lo que el jabón ideal se obtiene de una mezcla de ambos.
La reacción que tiene lugar se representa de forma general por la siguiente ecuación:
Donde R representa a la cadena carbonada del ácido.
Ejemplo: CH3- ( CH2)10-COOH + NAOH = NaCOO-(CH2)10-CH3 + H2O
Los productos de la reacción son una sal y agua, lo que confirma su carácter de reacción de neutralización.
Para identificar las reacciones de neutralización se utilizan indicadores ácido-base, como la Fenolftaleína, el Tornasol, etc.
Estos indicadores son sustancias que poseen la capacidad de cambiar su coloración según el grado de acidez de una disolución (pH). Así la Fenolftaleína que en presencia de bases (pH>7) adquiere un color rojo violáceo, pierde su color al agregar un ácido a esta disolución, lo que demuestra que el grado de acidez disminuyó y con ello se neutralizó el carácter básico.
En primer lugar, se debe enfatizar que si una reacción de neutralización se inicia con cantidades iguales del ácido y de la base (en moles), cuando finaliza dicha reacción se obtiene solamente una sal; es decir, no hay cantidades residuales de ácido o base.
Además, una propiedad muy importante de las reacciones ácido-base es el pH, el cual indica qué tan ácida o básica es una solución. Este se determina por la cantidad de iones H+ que se encuentran en las soluciones medidas.
En las reacciones de un ácido fuerte con una base fuerte se lleva a cabo la neutralización completa de las especies, como en la reacción entre el ácido clorhídrico y el hidróxido de bario:
2HCl(ac) + Ba(OH)2(ac) → BaCl2(ac) + 2H2O(l)
Así que no se generan iones H+ u OH– en exceso, lo cual significa que el pH de las soluciones de electrolitos fuertes que se han neutralizado está intrínsecamente relacionado con el carácter ácido de sus reactantes.
Por el contrario, en el caso de la neutralización entre un electrolito débil y uno fuerte (ácido fuerte + base débil o ácido débil + base fuerte) se obtiene la disociación parcial del electrolito débil y aparece la constante de disociación del ácido (Ka) o de la base (Kb) débil, para determinar el carácter ácido o básico de la reacción neta mediante el cálculo del pH.
Por ejemplo, se tiene la reacción entre el ácido cianhídrico y el hidróxido de sodio:
HCN(ac) + NaOH(ac) → NaCN(ac) + H2O(l)
En esta reacción el electrolito débil no se ioniza notablemente en la solución, por lo que se representa la ecuación iónica neta de la siguiente manera:
HCN(ac) + OH–(ac) → CN–(ac) + H2O(l)
LABORATORIO
VASO No. 1
Ácido nítrico + hidróxido de potasio ---> agua + nitrato de potasio
HNO3 + KOH ---- H2O + KNO3
VASO No.2
Ácido clorhídrico + hidróxido de potasio ---> agua + cloruro de potasio
HCL + KOH----H2O + KCL
VASO No.3
Ácido nítrico + hidróxido de sodio ---> agua + nitrato de sodio
HNO3 + NaOH---- H2O + NaNO3
VASO No. 4
Ácido clorhídrico + hidróxido de socio ---> agua + cloruro de sodio
HCL + NaOH----H2O + NaCL
TEMA: PH
Introducción
La presente investigación se refiere al tema del pH, que se puede definir una medida de acidez o alcalinidad de una disolución El pH indica la concentración de iones de hidrógeno presentes en determinadas disoluciones. La sigla significa potencial de hidrógeno o potencial de hidrogeniones.
La sigla pH significa Potencial de Hidrógeno, y consiste en un índice que indica la acidez, neutralidad o alcalinidad de un medio cualquiera. El pH es una característica de todas las sustancias determinadas por la concentración de iones de hidrógeno (H +). Cuanto menor es el pH de una sustancia, mayor es la concentración de iones H + y menor la concentración de iones OH-.
Según Arrhenius, un medio que presenta hidronios es ácido, y el que presenta hidróxidos es básico.Para analizar este tema, fue necesaria la intervención de la maestra y la experimentación en la plataforma de Yenka.
Objetivos
- Profundizar sobre el tema pH.
- Comprender los elementos que presentan un pH ácido y alcalino.
- Conocer los métodos de descubrimiento y clasificación de los diferentes elementos que se encuentran en la naturaleza.
- Conocer la diferencia entre ácido y base.
Marco teórico
¿Qué es?
Se trata de una unidad de medida de alcalinidad o acidez de una solución, más específicamente el pH mide la cantidad de iones de hidrógeno que contiene una solución determinada, el significado de sus sigla son, potencial de hidrogeniones, el pH se ha convertido en una forma práctica de de manejar cifras de alcalinidad, en lugar de otros métodos un poca más complicados.
Tiene un rango que va desde 0 a 14. Una sustancia con pH entre 0 y 7 es una sustancia ácida y una sustancia entre 7 y 14 es una sustancia alcalina. El agua potable tiene un pH entre 6 y 9. Fuera de esos valores sería perjudicial para la salud, puesto que sería corrosiva. Cuando 2 sustancias tienen diferente pH (siendo una ácida y la otra alcalina) crean una reacción. Uno de los productos conocidos más ácidos sería el ácido clorhídrico (con pH menor de 1) y uno de los más alcalinos que conocemos sería la lejía (con pH cercano a 14).A nivel de definición o concepto, de forma técnica, el pH El pH indica la concentración de iones del átomo de hidrógeno (H+) presentes en una disolución. La sigla de pH significa potencial de hidrógeno.
Escala de pH
La escala del pH es una escala numérica que va de 0 a 14. El conocimiento de la escala es fundamental para poder trabajar con el pH. Aquí puedes ver la escala del pH. Verás que es una escala que va del 1 al 14, donde entre el 1 y el 7 corresponden al pH ácido y entre 7 y 14 al pH alcalino. Los productos ácidos son aquellos productos que van a tener un pH menor que 7, ya sea ácido cítrico, bórico o cualquier tipo de ácido.
La escala del pH va desde 1, para las sustancias más ácidas, hasta 14 para las sustancias más alcalinas. El pH neutro, es el 7 y corresponde al agua destilada. Los colores de la escala pH sólo dependen del patrón que se esté utilizando.
PH ÁCIDO
Son llamadas sustancias ácidas, que son las sustancias que tienen un pH menor que 7 tienen una serie de propiedades comunes que las hacen muy fácil de distinguir:
- Las sustancias ácidas tienen sabor agrio o ácido, como los cítricos, el vinagre, o la aspirina (ácido acetil salicílico).
- Reaccionan con las bases (sustancias alcalinas) en reacciones ácido – base, dando una sal y agua.
- Los ácidos reaccionan con metal formando sal e hidrógeno, H2. Hay que tener cuidado en la reacción de un ácido con un metal por esta generación de hidrógeno. Aquí puedes ver la reacción entre Al y HCL.
- Con óxidos metálicos reaccionan para producir una sal y agua. De esta forma los ácidos suelen ser buenos para la limpieza de la corrosión.
- Producen quemaduras en la piel.
- Conducen la electricidad en disolución
PH ALCALINO
Las sustancias con pH mayor que 7, son las llamadas sustancias alcalinas o básicas y tienen también características comunes, que son:
- Las sustancias alcalinas se disuelven en agua.
- Reaccionan con los ácidos en las llamadas reacciones ácido – base, dando de resultado una sal y agua.
- Tienen un sabor algo amargo
- Son conductores eléctricos
- Disuelven la grasa, y por ello son utilizados en jabones. Pero un pH elevado es irritante para la piel
Algunos ejemplos de bases conocidas son la lejía, amoniaco, detergente, hidróxido de sodio.
CARACTERÍSTICAS
El pH, tiene un valor relacionado directamente con las concentraciones y cantidades del hidroxilo e hidrógeno. Cuando el resultado da una concentración más alta de hidrógenos que de hidroxilo, el resultado será la medida de una sustancia básica. Si por el contrario, el hidroxilo resulta tener una mayor concentración, tendremos una sustancia ácida y si las medidas son iguales, tendremos entonces una composición neutra.
El conocimiento de todos estos datos, solo se puede saber mediante la medida que arroja el medidor de pH, gracias a esta, podemos conocer con exactitud, el tipo de sustancia con la que trabajaremos, así como las consideraciones que se deben tener en su manejo.
¿ CÓMO SE MIDE EL PH?
El pH de una sustancia se puede medir por el método colorimétrico o el potenciométrico. El colorimétrico es más sencillo y utiliza sustancias llamadas indicadores de pH que se pueden encontrar en diferentes presentaciones con propiedades particulares para medir rangos de pH específicos. El indicador más común es el papel tornasol, que se trata de una tira de papel con un tratamiento especial que al sumergirse en una solución cambia de color, ya sea azul para las sustancias alcalinas, o rojo para las soluciones ácidas. Los papeles tornasol se encuentran disponibles para medir diferentes rangos en la escala de pH gracias al compuesto químico con el que están tratados.
Para elegir el indicador de pH adecuado se recomienda conocer el rango aproximado en el que se encuentra la sustancia que se vaya a medir, en caso de que no se sepa este dato es necesario hacer varias mediciones utilizando indicadores con distintas sensibilidades hasta dar con el apropiado. Aunque los papeles tornasol son muy prácticos, si se trabaja con soluciones turbias o coloreadas los datos pueden perder precisión porque fácilmente se puede enmascarar el color, en estos casos es mejor optar por el método potenciométrico, un medidor de pH que utiliza un voltímetro altamente sensible que conectado a dos electrodos generará una corriente eléctrica que varía dependiendo de la concentración de hidrones en la solución.
En El Crisol encontrarás medidores de pH de la más alta calidad que se adapte a tus necesidades. Te invitamos a consultar nuestro catálogo en línea y a ponerte en contacto con nosotros para recibir asesoría especializada en la elección del medidor de pH que cubra mejor sus necesidades.
INDICADORES DE pH
Fenoftaleína: Es un indicador de pH que en soluciones ácidas permanece incoloro, pero en presencia de bases se torna rosa o violeta. Es un sólido blanco, inodoro que se forma principalmente por reacción del fenol, anhídrido ftálmico y ácido sulfúrico (H2SO4); sus cristales son incoloros.
El cambio de color está dado por la siguiente ecuación química :H2Fenolftaleína Ácido Incoloro↔Fenolftaleína2-AlcalinoRosa↔Fenolftaleína(OH)3 Muy AlcalinoIncoloro NO ES SOLUBLE EN AGUA, con lo que normalmente se disuelve en alcohol para su uso en experimentos. La fenolftaleína es un ácido débil que pierde cationes H+ en solución. La molécula de fenolftaleína es incolora, en cambio el anión derivado de la fenolftaleína es de color rosa. Cuando se agrega una base la fenolftaleína (siendo esta inicialmente incolora) pierde H+ formándose el anión y haciendo que tome coloración rosa.
Este compuesto en realidad cambia de color a través de un proceso llamado ionización. La ionización es lo que sucede cuando se añaden o eliminan los iones de carga positiva o negativa de una molécula, que puede convertir la molécula en un ion. Phenolphthalein contiene iones de hidrógeno cargados positivamente, pero cuando se expone a una solución alcalina, se eliminan estos iones. En general, la molécula de fenolftaleína es incolora naturalmente, pero su ion es de color rosa brillante, por supuesto. Cuando los iones de hidrógeno se eliminan de la solución, fenolftaleína molécula incoloro ioniza y cambios a iones de fenolftaleína de color rosa. Cuanto más fuerte sea la solución alcalina es, más iones de hidrógeno se eliminan y las sombras oscuras de la fenolftaleína rosa será.
Indicador Universal: Un indicador universal es un indicador de pH hecho de una solución de varios compuestos que exhibe varios cambios de color suaves en un amplio rango de valores de pH para indicar la acidez o alcalinidad de las soluciones. Aunque hay varios indicadores universales de pH disponibles en el mercado, la mayoría son una variación de una fórmula patentada por Yamada en 1933. Los detalles de esta patente se pueden encontrar en Chemical Abstracts . Los experimentos con el indicador universal de Yamada también se describen en el Journal of Chemical Education .
Un indicador universal está compuesto típicamente de agua , fenolftaleína sódica sal, hidróxido de sodio, rojo de metilo , bromotimol azul sal monosódica y timol azul sal monosódica.
Es una solución formada por una mezcla de compuestos que presentan comportamiento de indicador ácido-base: permite medir la acidez o alcalinidad de un medio con el cambio de color al cambiar el pH de la disolución en un rango que va del 1 al 14. El cambio de color se debe a un cambio estructural inducido por la protonación o desprotonación de la especie de interés. Es posible apreciar un cambio de color cuando la concentración del componente ácido es al menos 10 veces superior a la del componente básico o viceversa.
Papel tornasol:El Papel tornasol o Papel pH es utilizado para medir la concentración de Iones Hidrógenos contenido en una sustancia o disolución. Mediante la escala de pH, la cual es clasificada en distintos colores y tipos.
El papel tornasol se sumerge en soluciones y luego se retira para su comparación con la escala de pH. El papel de tornasol es uno de los más antiguos indicadores ácido-base. Llegó a ser conocida ampliamente debido a sus cualidades: práctico, económico y eficiente para medir el pH.
El papel de tornasol puede presentarse en tres colores diferentes: rojo, azul o neutro. El tornasol rojo se utiliza para probar las bases; el tornasol azul para probar ácidos y el tornasol neutro para probar ambos. El papel de tornasol cambia de color al ponerse en contacto con una solución particular. Ejemplo: el papel de tornasol azul, en presencia de una solución ácida, cambia el color de azul a rojo. Esto es porque los iones reaccionan cambiando la disposición de los átomos presentes en el indicador. El papel tornasol rojo en contacto con una base, cambia del color rojo para el azul. El papel neutro, en contacto con ácidos, se vuelve rojo; en contacto con bases, se vuelve azul.
LABORATORIO
Fenolftaleína
Universal
Tornasol
TITULACIÓN
Introducción
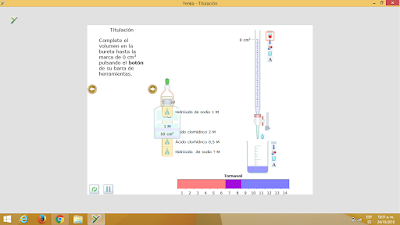
La presente investigación se refiere al tema dela titulación, que se define como,es un método de análisis químico cuantitativo en el laboratorio que se utiliza para determinar la concentración desconocida de un reactivo a partir de un reactivo con concentración conocida. Con la titulación puede determinar la concentración desconocida en un líquido añadiéndole reactivos de un contenido conocido. La titulación es un procedimiento relativamente sencillo que no requiere un despliegue de aparatos técnicos para determinar la concentración de sustancias conocidas disueltas. Los instrumentos esenciales para la titulación son una bureta y un vaso de precipitados. La bureta contiene una solución volumétrica de la cual se conoce la concentración de la sustancia. En el vaso de precipitados se encuentra la solución con la concentración desconocida y un indicador para la detección del parámetro. Después de mezclar la solución volumétrica y la solución con la muestra en el vaso de precipitados es posible, en base al conocimiento del desarrollo químico de reacción y el consumo de la solución volumétrica, calcular la concentración de la solución con la muestra. Para analizar este tema, fue necesaria la intervención de la maestra y la experimentación en la plataforma de Yenka.
Objetivos
- Reconocer este método, para así poderlo emplear de la manera correcta.
- Tener en cuenta cada una de las titulaciones para así, saber cuál le corresponde a cada elemento.
- Determinar la concentración de una solución desconocida por medio de la herramienta de la titulación
- Reconocer el significado de la titulación y su importancia.
Marco teórico
¿Qué es?
Es el método por el cual se determina una cantidad desconocida de una sustancia particular, mediante la adición de un reactivo estándar que reacciona con ella en proporción definida y conocida.
La adición de un reactivo estándar (un reactivo de concentración conocida y frecuentemente denominado como reactivo titulado) se regula y se mide de alguna forma, requiriéndose un método de indicación para saber cuando la cantidad de reactivo normal juntado y precisamente la suficiente para reaccionar cuantitativamente con la sustancia que se determina.
Como consecuencia, conociendo la proporción en que reaccionan las sustancias y teniendo determinada la cantidad de una sustancia (el reactivo titulado) necesaria para reaccionar en esta proporción, se puede calcular fácilmente la cantidad desconocida de sustancia presente en el frasco de reacción.
En una titulación, el punto en que la cantidad de reactivo titulado adicionado es exactamente suficiente para que se combine en una proporción estequiométrica, o empíricamente reproducible con la sustancia que se determina, se llama punto de equivalencia.
El punto final de una titulación debe coincidir con el punto de equivalencia o estar muy próximo de él. La diferencia entre los puntos de equivalencia y final se llama intervalo del indicador.
Las titulaciones se realizan casi siempre con soluciones o disoluciones, sin embargo también es fácil realizarlas con sustancias en los estados gaseosos, sólido y de fusión, si se dispone de equipo adecuado.
Después de mezclar la solución volumétrica y la solución con la muestra en el vaso de precipitados es posible, en base al conocimiento del desarrollo químico de reacción y el consumo de la solución volumétrica, calcular la concentración de la solución con la muestra. Los diferentes procedimientos de titulación se pueden separar según los tipos de reacción químicos.
CARACTERÍSTICAS
Partiendo de la base que una titulación, cualquiera sea la reacción, se realiza para conocer la concentración de un determinado analito. Los métodos de análisis los podemos clasificar en dos tipos de acuerdo a como se llega a la concentración desconocida.
- Directos: El parámetro que se mide tiene alguna relación directa con el analito por lo que permite conocer directamente la concentración del mismo. Es la característica de los sensores. La muestra permanece inalterada.
- Indirectos: A partir de un parámetro que se mide en el momento que el analito reacciona completamente, se calcula la concentración que tenia en la muestra inicial. En la muestra analizada no existe mas el analito.
De acuerdo a la definición anterior las titulaciones se encuentran dentro de los métodos indirectos de análisis, ya que midiendo el volumen de titulante que se requiere para alcanzar el punto final es posible calcular la concentración inicial del analito en la muestra problema.
Tipos
- Titulación ácido-base: El fundamento de la titulación ácido-base es la reacción de neutralización entre ácidos y base. Como solución volumétrica se selecciona un ácido o base como complemento a la solución de prueba. Mediante la titulación se consigue una neutralización entre iones H3O+- y OH-. Si se alcanza el valor pH 7 la solución es neutra; añadiendo más solución volumétrica la solución de prueba se volverá más ácido o básico. Si se registra en una curva el desarrollo del valor pH a través de todo el desarrollo de la reacción, es posible determinar la cantidad a raíz del punto de equivalencia (valor pH 7).
- Titulación Redox: En la titulación redox se deja reaccionar la solución de prueba con una solución volumétrica oxidada o reducida. Se añade la solución volumétrica hasta que todas las sustancias que puedan reaccionar en la solución de prueba hayan sido oxidadas o reducidas. Solamente se consiguen resultados si el punto de saturación de la solución de prueba no se sobrepasa añadiendo más solución volumétrica. Por tanto, es imprescindible conocer el punto de saturación para determinar con precisión el valor de medición. Esto se consigue de forma muy precisa mediante indicadores químicos o potenciométricos.
- Titulación por precipitación: La titulación por precipitación combina muy bien sustancias muy solubles con sustancias que no se diluyen tan bien. Se consigue obtener el resultado una vez que la reacción química se ha completado y sea claramente visible la caída de la sustancia que se diluye con dificultad.
LABORATORIO
CONCLUSIONES:
- Cada elemento presenta un pH, que se puede clasificar entre ácido y alcalino, los ácidos antes de utilizarse deben de estar perfectamente valorados con soluciones alcalinas con normalidad conocida.
- La utilización de los indicadores son importantes, pues, estos nos señalan o enseñan el nivel de pH del elemento que se quiera disponer.
- La neutralización se produce por medio de una disolución ácida y básica.
- Comprender el concepto de neutralización y de la misma manera entender que ácidos deben utilizar para realizar esta.
WEBGRAFÍA:
- https://www.tplaboratorioquimico.com/quimica-general/acidos-y-bases/neutralizacion.html
- http://www.ehu.eus/biomoleculas/ph/neutra.htm
- https://es.wikipedia.org/wiki/Reacci%C3%B3n_%C3%A1cido-base
- http://recursostic.educacion.es/newton/web/materiales_didacticos/acidosbases/reacacidobase.html
- https://quimica-reacciones-quimicas.webnode.mx/neutralizacion/
- http://www3.gobiernodecanarias.org/medusa/lentiscal/1-CDQuimica-TIC/applets/Neutralizacion/teoria-neutralizacion.htm
- https://es.wikipedia.org/wiki/PH
- https://conceptodefinicion.de/ph/
- https://concepto.de/ph/
- https://es.wikipedia.org/wiki/An%C3%A1lisis_volum%C3%A9trico
- https://www.pce-iberica.es/instrumentos-de-medida/instrumentos-laboratorios/titulacion.htm













































FALTO EJERCICIOS DE NEUTRALIZACION 4,4
ResponderEliminar